Caractérisation
des tissus par fluorescence et spectroscopie Raman
Président de Session: Monsieur
S. Mottin
Spectroscopie résolue en temps
sous excitation laser femtoseconde accordable 440-480nm
au niveau cérébral chez le rongeur non contraint.
1
Lab. Traitement du Signal et Instrumentation , CNRS UMR 5516, St-Etienne,
France
2 Lab. Biologie Animale et
Appliquée, Université Jean Monnet, St-Etienne, France
3 Lab. Neurobiologie des Etats
de sommeils et d'éveil, INSERM U480, Lyon, France
email: mottin@ univ-st-etienne.fr
La fluorescence induite au niveau de 2 structures cérébrales (cortex et noyau du raphe dorsalis) a été mesurée par comptage 2D de photo-électron unique sous excitation laser femtoseconde accordable 440-480 nm de haute cadence (1 KHz). Des solutions de lait non diluées et diluées ainsi que des solutions limpides de flavine ont été utilisées comme modèles. Les propriétés d'autofluorescence du liquide céphalo-rachidien prélevé au niveau de la cisterna magna chez le rat seront détaillées. Enfin, nous discuterons la correspondance entre le signal optique mesuré et l'information moléculaire sous-jacente, attendue par les neurobiologistes.
Il apparaît que la majeure partie de l'autofluorescence détectée dans ce domaine spectral proviendrait des flavoproteines mitochondriales, en particulier de l'a-lipoamide dehydrogenase.
Au delà de l'intérêt de suivre le métabolisme énergétique in vivo, ce domaine spectral intéresse de nombreux biologistes du fait de l'extraordinaire croissance des applications relatives aux outils biomoléculaires de la E-GFP (enhanced green fluorescent protein). L'établissement des lignées d'animaux transgéniques qui expriment ce fluorophore comme gène rapporteur arrive maintenant à maturité. De nombreux problèmes existent cependant pour la mesure in vivo de la fluorescence associée à la E-GFP. Les propriétés optiques des tissus dans des conditions in vivo constituent une barrière tenace.
Pour les spécialistes de la GFP, l'autofluorescence est considérée comme un bruit indésirable masquant le signal de fluorescence liée à la faible expression d'un gène. Nous défendrons l'idée que ce bruit est en fait un signal lié aux flavoproteines mitochondriales et qu'il peut évoluer de manière importante suivant les conditions expérimentales. Dans ce sens, les premiers résultats obtenus sur différentes souches de souris E-GFP montrent que la méthode que nous préconisons pourrait permettre de mesurer une activité génique in vivo chez l'animal non anesthésié. Une telle évaluation pourrait permettre de coupler les avancées de la génétique moléculaire à la physiologie.
(N.B. Toutes les mesures
rapportées ont été obtenues dans des conditions expérimentales
en respect avec les directives de l'UnionEuropénne
sur l'expérimentation animale (86/609/EEC))
Spectroscopie d'autofluorescence
de l'úsophage et de l'endobrachyoesophage : Caractérisation tissulaire
et application à la détection de tumeurs précoces
Geneviève Bourg-Heckly1,
Jocelyne Blais1, Jacques Etienne2,
Olivier Bourdon1, Juan-José
Padilla3,François
Guillemin3
1
Université Pierre et Marie Curie. Laboratoire dePhysicochimie Biomoléculaire
et Cellulaire; CNRS ESA 7033. Tour 22, Case138, 4 place Jussieu, 75252
Paris cedex 05. France
Tél: 33 (0)1 44 27
75 63; Fax: 33 (0)144 27 75 60; e-mail: bourghec@lpbc.jussieu.fr
2
Centre de Thérapie PhotodynamiquePluridisciplinaire, clinique Les
Martinets, 97 av Albert 1er
92500 Rueil Malmaison. France.Tél: 33 (0)1 40 6793 93; Fax: 33 (0)1
40 67 76 08
3
Centre Alexis Vautrin 54511 Vandoeuvre les Nancycedex. France Tel: 33 (0)3
83 59 84 87; Fax: 33 (0)3 83 44 60 71;e-mail: f.guillemin@nancy.fnclcc.fr
Contexte: En
France, le cancer de líoesophage,avec
10 000 nouveaux cas diagnostiqués par an,estla quatrième
cause de décès par cancer chez líhomme. Lamoitié de
ces cancers se sont développés sur desendobrachyoesophages
(EBO), anomalie de la muqueuse de la partieinférieure de líoesophage
créée par le reflux oesophagien, qui augmente fortement lerisque
de développer un carcinome. Le diagnostic, le plus souventtardif,
conduit à une survie à 5 ans voisine de 5%. En revanche undiagnostic
et traitement précoces permettent une survie à 5 ans de95%.
Malheureusement les lésions cancéreusesprécoces de
líoesophage sont le plus souvent invisibles àlíexamen endoscopique.
La méthode préconisée actuellement pourdétecter
ce type de lésion est d'effectuer systématiquement denombreuses
biopsies réparties sur l'ensemble de la muqueuse; cette technique
estinvasive et lourde à appliquer. La perspective d'un diagnostic
parbiopsie optique fondée sur la spectroscopie d'autofluorescence
est doncici particulièrement attrayante.
Méthodes:Le
principe de détection repose sur le fait que l'autofluorescence
des tissus sains et tumorauxprésentent de fortes différences
à la fois sur le plan del'intensité émise et de la
forme du spectre. La longueur díonde díexcitation est 330 nm.Líacquisition
des spectres de fluorescence tissulaires in vivosíeffectue au moyen díun
spectrofluorimètre à fibres optiquesconstruit dans notre
laboratoire. Le faisceau de fibres optiques, introduitdans le canal opérateur
de líendoscope et amené aucontact du tissu, sert díune part à
conduire la lumièreexcitatrice jusquíau site tissulaire à
examiner et díautre partà recueillir la fluorescence émise
par celui-ci. Les mesures ontété effectuées sur 23
patients. La détermination de la distribution spectralecaractéristique
de chaque type histologique est faite en utilisant les 3rapports díintensité
de fluorescence R1 = I390
nm / I450nm, R2
= I550 nm / I450nm,
R3 = I390nm
/ I550nm.
Résultats:
Líautofluorescence présente 3 bandescorrespondant à líémission
du collagène (autour de 390 nm), duNADH (autour de 450 nm) et des
flavoprotéines (autour de 520 nm).Les
distributions spectrales relatives à lamuqueuse malpighienne oesophagienne
saine et à la muqueusespécialisée de líEBO non dysplasique
sont similaires. Laprésence díune dysplasie de haut grade ou díun
carcinome in situse traduit par une modification de la distribution spectrale.
Líanalysestatistique montre que la modification spectrale associée
à latransformation néoplasique est plus forte que les variations
intra etinter patients. Ces résultats ont permis la détermination
decritères de discrimination fondés sur les rapports R1
et R3. Líutilisation du rapport
R3 permet de différencier
le tissu néoplasique dela muqueuse malpighienne et de la muqueuse
de Barrett avec unesensibilité de 85% et une spécificité
de 94%.
Conclusion:La
spectroscopie díautofluorescence UV, en permettant líorientation des biopsies,
devrait accroîtrelíefficacité diagnostique de líendoscopie
conventionnelle.
Détection de processus inflammatoires pancréatiques par imagerie de fluorescence
Schunck T.1, Sowinska M.1, Martz A.1, Wack S.2, Heisel F.1, Cunin B.1, Aprahamian M.2
1Groupe
díOptique Appliquée, Laboratoire PHASE, 23, rue du Lúss, 67200 Strasbourg
Tel
: 33.(0)3.88.10.65.59, Fax : 33.(0)3.10.65.48, tschunck@goa.c-strasbourg.fr
2Département
de Technologie Photodynamique, IRCAD, Hôpital Civil, 67091 Strasbourg
Tel
: 33.(0)3.88.11.90.22, Fax : 33.(0)3.11.90.99, Marc.Aprahamian@ircad.u-strasbg.fr
La fluorescence endogène est un outil puissant pour évaluer l'état physiopathologique des tissus, les teneurs en chromophores de tissus lésés ou pathologiques étant différentes de celles des tissus sains. Si son application au diagnostic de cancers a fait líobjet de nombreux travaux, son utilisation pour le dépistage des inflammations est totalement originale. Le présent travail porte sur la faisabilité de l'utilisation de la fluorescence endogène pour détecter et localiser in vivo des processus inflammatoires au niveau du pancréas chez le rat.
Les propriétés de fluorescence de tissus pancréatiques sains et pathologiques issus de modèles animaux de pancréatites chronique et aiguë ont été étudiées in vitro pour deux longueurs díonde díexcitation, 355 nm et 400 nm. Les spectres de pancréas sain présentaient une large bande de fluorescence dans le bleu avec un maximum à 470 nm et un léger pic vers 630 nm, de plus grande importance sous excitation à 400 nm quíà 355 nm. Les pancréatites chroniques ou aiguës se signalaient par une augmentation relative de la fluorescence rouge toujours moins marquée sous excitation à 355 nm quíà 400 nm. De plus, un déplacement du maximum de la fluorescence bleue de 470 nm à 500 nm était observé sous excitation à 400 nm. La fluorescence rouge présentait deux maximums (à 630 nm et 690 nm) reproduisant le spectre d'émission de la protoporphyrine IX (PP IX), le précurseur de l'hémoglobine. Les spectres de pancréas de rats porteurs ou non de pancréatite réalisés in vivo possédaient des caractéristiques similaires. La synthèse endogène de PP IX semble être augmentée lors díinflammations et la différence entre les propriétés spectrales de tissus sains et de tissus lésés est plus importante sous excitation à 400 nm.
Une imagerie de fluorescence mettant à profit le contraste existant entre les teneurs en PP IX des tissus inflammatoires et des tissus sains, donc entre les intensités de fluorescence rouge et de façon plus nette entre les rapports d'intensités rouge/bleue, doit permettre de détecter et cartographier les zones lésées. Des tests de faisabilité díimagerie ont été réalisés in vivo sur des rats sains et porteurs de pancréatite aiguë sous excitation à 355 et 400 nm. Quatre images de fluorescence étaient enregistrées : à 470 nm pour la fluorescence bleue, à 630 et 690 nm pour celle de la PP IX et à 600 nm pour estimer l'émission rouge non due à la PP IX. Pour une excitation à 355 nm, les images níont pas permis pas de distinguer les tissus sains des tissus lésés, confirmant ainsi les résultats obtenus par spectroscopie. Par contre, une très bonne discrimination a été obtenue sous excitation à 400 nm. Dans les images (I630-I600)/I470, résultant de la division pixel à pixel de l'image de fluorescence de la PP IX (I630-I600) par l'image obtenue à 470 nm, le signal était absent pour le pancréas sain et d'intensité corrélée à la gravité des lésions pour les pancréatites. Ces résultats sont illustrés sur la figure suivante.

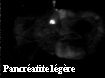
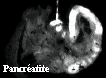
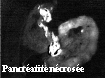
*Ce
travail est réalisé dans le cadre du programme européen
DG XIII innovation.
Imagerie de fluorescence in-vivo
de cancers précoces
dans l'arbre trachéo-bronchique
Didier Goujon1,
Matthieu Zellweger1, Alexandre Radu2, Norbert Lange1,
Bernd-Claus Weber3, Philippe Monnier2, Georges Wagnières1,
Hubert van den Bergh1
1 DGR-LPAS,
Institute of Environmental Engineering, Swiss federal Institute of technology
(EPFL), CH-1015 Lausanne
(Switzerland)
tel:
++41-21-693-39-29, email:
Didier.Goujon@epfl.ch
2 ENT Clinic,
CHUV Hospital, CH-1011 Lausanne (Switzerland)
tel:
++41-21-314-27-45, email:
Alexandre.Radu@chuv.hospvd.ch
3 RICHARD
WOLF GmbH, Postfach 1164, D-75434 Knittlingen (Germany)
tel:
++44-7043-35339, email:
Bernd-Claus.Weber@richard-wolf.com
Résumé:
Les fluorophores endogènes sont nombreux. Ils sont naturellement présents dans les tissus et sont responsables de la fluorescence de tous les tissus biologiques (autofluorescence). Il est rapporté que l'autofluorescence des bronches change lors du processus de cancérisation, lorsque de normal le tissu devient dysplasique, puis carcinomateux. En fait, les lésions montrent une diminution de la fluorescence dans la région spectrale "verte" (» 500 nm), ce qui est également rapporté comme une augmentation relative de l'intensité de fluorescence dans la région spectrale "rouge" (» 600 nm).
Un appareillage d'imagerie de fluorescence basé sur ce principe a été développé et mis au point à l'Ecole Polytechnique Fédérale de Lausanne, dans le cadre d'une collaboration avec la société Richard Wolf Endoskope Gmbh.
Le système utilise une Lampe Xénon de 300W comme source d'excitation de la fluorescence. Il est composé d'une caméra CCD N/B. Deux images sont formées sur ce détecteur, une pour chaque région spectrale investiguée (régions "verte" et "rouge"). Les deux images sont ensuites superposées l'une sur l'autre à l'aide d'un processeur vidéo, permettant ainsi la visualisation de l'image résultante. La présence d'une lésion sur le tissu bronchique apparaîtra alors comme une zone "rouge-brun". Ce dispositif de photodétection prend place dans un boitier fixé sur un endoscope classique et permet également l'observation du site en lumière blanche, grâce à une optique rotative.
Cet instrument a été testé dans le cadre d'une étude clinique depuis Septembre 1999. Cette étude montre que l'autofluorescence peut aider à la détection de lésions bronchiques précoces, qui peuvent demeurer invisibles en lumière blanche.
La sensibilité du système en mode d'autofluorescence
est supérieure à celle du système en mode lumière
blanche. De plus, une étude sytématique des composantes rouges
et vertes des images de fluorescence montre qu'un seuil décisonnel
défini à partir du rapport vert/rouge permet d'éliminer
une grande proportions des "faux-positifs". Ainsi après traitement,
la valeur prédictive positive (PPV) de l'autofluorescenec est supérieure
à 70 %, alors que celle obtenue avec la lumière blanche est
de seulement 33%. Enfin, la combinaison des deux méthodes permet
d'atteindre une PPV de 100%.
Applications de la spectrométrie
Raman
au domaine du biomédical
Nguyen Quy Dao et
Michel Jouan
Laboratoire SPMS, UMR
8580
Ecole Centrale Paris
Grande Voie des Vignes
F-92295 Chatenay-Malabry
Cedex
(nqdao@pcm.ecp.fr ,
jouan@pcm.ecp.fr)
La spectrométrie Raman présente de très nombreux avantages par rapport aux autres méthodes spectroscopiques. Il síagit díune méthode díanalyse qualitative et quantitative non destructive de la composition chimique díun mélange solide, liquide ou gazeux et son association avec les fibres optiques mise au point dans notre Laboratoire en fait une méthode díanalyse in situ extrêmement intéressante. Depuis de nombreuses années, notre Laboratoire síest intéressé à líapplication de la spectrométrie Raman au domaine biomédical.
Deux directions de recherche ont été explorées : il síagit de la détection de líathérosclérose et de la détermination des diverses étapes de líévolution de cette maladie d'une part, et de la détermination de la composition chimique des calculs urinaires et biliaires d'autre part.
Síagissant de líathérosclérose, nous avons pu valider les résultats de la méthode Raman mesurant les différentes compositions de la plaque athérocléreuse avec les méthodes arbitres standards et, grâce à líassociation avec les fibres optiques, montré la faisabilité pour des mesures in situ et in vivo.
Pour les calculs urinaires et biliaires, nous avons montré que la méthode est capable díeffectuer des microanalyses de la composition des calculs depuis la genèse jusquíau stade stabilisé final.
Nous exposerons dans la conférence quelques
résultats de cette recherche obtenus récemment dans notre
Laboratoire.
Caractéristiques
physico-chimiques et propriétés de fluorescence
du vert d'indocyanine dans
les milieux complexes
J.M.
Devoisselle1, S. Bégu1, T. Desmettre2,
S.Mordon2
1
: UMR CNRS/ENSCM 5618 & Lab. Techn.
Pharm. Ind., Fac. Pharmacie,
Montpellier
devoisse@pharma.univ-montp1.fr
2
: INSERM-EA 2084 IFR 22, pavillon Vancostenobel, CH&U, Lille
Le
vert díindocyanine (ICG) est un colorant de la famille des tricarbocyanines
(1). Il a été introduit en clinique comme colorant díexploration
fonctionnelle (hépatique) et ses propriétés de fluorescence
ont été aussi exploitées en angiographie de fluorescence
dans le domaine de líophtalmologie (2). Récemment, ce colorant a
été employé comme absorbeur optique dans le cadre
de la photocoagulation des vaisseauxpar
laser (3,4). En effet, les diodes lasers émettant dans le proche
infrarouge à 805 nm permettent une absorption lumineuse par le colorant
qui se traduit par une élévation de la température
de la zone concernée sans dommage des tissus adjacents. Cependant
peu de travaux font état des caractéristiques díabsorption
et de fluorescence de cette molécule in vitro et in vivo. Nous avons
donc étudié ses propriétés spectrales dans
des milieux complexes (modèles et biologiques).
LíICG
présente des propriétés agrégatives dans líeau
en fonction de sa concentration. Les spectres díabsorption sont modifiés
dans líeau et restent inchangés dans le sérum et le sang
total. En présence de modèle membranaire (liposomes), les
résultats montrent que líICG est capable díinteragir avec les phospholipides
de la paroi liposomale et ceci de façon différente selon
la surface de líinterface disponible. Le maximum díémission de líICG
est décalé vers les grandes longueurs díonde et atteint 830
nm pour une concentration lipidique de 0,3 mg/ml. Les courbesde
quenching de fluorescence de líICG dans líeau, en solution protéique
et dans le sang total permettent de déterminer les concentrations
extravasculaires ou intravasculaires capables de générer
ce phénomène. Cette propriété de quenching
a été aussi observée in vivo lors de prélèvement
sanguin. Cette étudedevrait
permettre de mieux comprendre le comportement de líICG in vivo.
Références
:
1-Cherrick
G.R., Stein S.W., Levy C.M. et al, J. Clin. Invest.,
1960, 39, 592-600.
2-Flower
R.W., Optical Engineering, 1995, 34,3,727-736.
3-Puliafito
C.A., Guyer D.R., Mones J.M., IOVS, 1991, 32, 4, S712.
4-Mordon
S., Desmettre T., Devoisselle J.M., Laser Surg. Med, 1999, 24, 5, 338-345.
Cartographie du pH tissulaire
par imagerie de fluorescence:
Applications diagnostiques
Xavier
Maréchal, Serge Mordon, Jean Marie Devoisselle, Vincent Maunoury,
Rémi Nevière, Bruno Buys, Claude Chopin
INSERM EA 2689-IFR 22, Pavillon Vancostenobel, CHRU de Lille, 59037 Lille
Tel/Fax : +33 (0) 320 446 708 Email : mordon@lille.inserm.fr